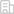搜 索
搜 索
 搜 索
搜 索
.jpg)
- 66 高校采購信息
- 215 科技成果項目
- 2 創(chuàng)新創(chuàng)業(yè)項目
- 0 高校項目需求
細(xì)菌DNA硫化修飾研究新進(jìn)展
上海交通大學(xué)生命科學(xué)技術(shù)學(xué)院、微生物代謝國家重點實驗室吳更教授與武漢大學(xué)王連榮、陳實教授團(tuán)隊合作,揭示了細(xì)菌DNA硫化修飾中催化第一步反應(yīng)的半胱氨酸脫硫酶發(fā)生構(gòu)象變化,使其活性位點半胱氨酸朝向底物半胱氨酸移動5.5埃以發(fā)起攻擊的催化機制。最新研究成果以“Structural Analysis of an L-Cysteine Desulfurase from an Ssp DNA Phosphorothioation System”為題發(fā)表在《mBio》雜志上。劉立瓊等為第一作者,吳更、王連榮為通訊作者,上海交通大學(xué)生命科學(xué)技術(shù)學(xué)院、微生物代謝國家重點實驗室為第一單位。本文是團(tuán)隊自2018年Nature Communications上發(fā)表的細(xì)菌采用SBD結(jié)構(gòu)域識別硫化修飾DNA的結(jié)構(gòu)機理及2020年Nature Microbiology上發(fā)表的II型DNA硫化修飾系統(tǒng)的SspB、SspE晶體結(jié)構(gòu)的延續(xù)和擴展。
在細(xì)菌的DNA硫化修飾(不管是早先發(fā)現(xiàn)的Dnd修飾系統(tǒng)還是新近發(fā)現(xiàn)的Ssp修飾系統(tǒng))途徑中,都由一個半胱氨酸脫硫酶催化第一步的反應(yīng),即半胱氨酸脫硫酶的活性位點半胱氨酸對底物半胱氨酸上的硫原子發(fā)起親核攻擊反應(yīng),將活化的硫原子轉(zhuǎn)移到半胱氨酸脫硫酶的活性位點半胱氨酸上,以進(jìn)行后續(xù)的將硫原子加進(jìn)DNA的反應(yīng)。2020年4月初團(tuán)隊在Nature Microbiology上發(fā)表的文章“SspABCD-SspE is a phosphorothioation-sensing bacterial defense system with broad antiphage activities”,從探索海洋弧菌的高頻單鏈磷硫酰化修飾入手,通過比較基因組學(xué)和分子遺傳學(xué)手段,鑒定出以SspABCD為修飾元、SspE為限制元的單鏈磷硫酰化限制-修飾系統(tǒng)。該系統(tǒng)與之前發(fā)現(xiàn)的磷硫酰化(以DndABCDE為修飾元以產(chǎn)生雙鏈DNA磷硫酰化、DndFGH為限制元)的Dnd系統(tǒng)均迥然不同,并首次闡明了細(xì)菌磷硫酰化限制-修飾系統(tǒng)賦予宿主抑制噬菌體入侵的能力。同時,通過結(jié)構(gòu)生物學(xué)和生物化學(xué)手段,解析了SspB蛋白的晶體結(jié)構(gòu),揭示其兩個保守motif的關(guān)鍵殘基對其DNA缺刻酶活性非常重要;解析了SspE蛋白的晶體結(jié)構(gòu),發(fā)現(xiàn)其N端結(jié)構(gòu)域有依賴于DNA磷硫酰化修飾的NTP水解酶活性,而其C端結(jié)構(gòu)域有DNA缺刻酶活性,從而闡明了該系統(tǒng)DNA磷硫酰化修飾與限制兩部分功能耦合的分子機理。研究還發(fā)現(xiàn)SspABCD作為修飾蛋白在宿主基因組DNA上產(chǎn)生磷硫酰化修飾,SspE作為限制元能夠感應(yīng)基因組DNA上的磷硫酰化修飾從而區(qū)別宿主自身與外源的遺傳物質(zhì),并利用其核酸酶活性對入侵噬菌體的DNA進(jìn)行大范圍的缺刻,從而抑制噬菌體DNA的復(fù)制。
本研究解析了新發(fā)現(xiàn)的II型DNA硫化修飾系統(tǒng)中的半胱氨酸脫硫酶SspA(來源于弧菌)與底物半胱氨酸的復(fù)合物晶體結(jié)構(gòu),分辨率為1.8埃。結(jié)構(gòu)揭示SspA通過其天冬酰胺N150和精氨酸R340殘基來識別底物半胱氨酸,如果將這兩個殘基突變則會嚴(yán)重破壞細(xì)菌的DNA硫化修飾。在結(jié)構(gòu)中,SspA的活性位點半胱氨酸C314與底物半胱氨酸的距離長達(dá)8.9埃,這就產(chǎn)生了一個有趣的問題——SspA是怎么催化脫硫反應(yīng)的?通過計算機分子動力學(xué)模擬,作者發(fā)現(xiàn)SspA的活性位點半胱氨酸C314在催化過程中向底物半胱氨酸移動了5.5埃,從而把它們之間的距離縮短到便于發(fā)生反應(yīng)的范圍內(nèi)。本研究通過簡正模式分析,發(fā)現(xiàn)弧菌的SspA、大腸桿菌的IscS、鏈霉菌的DndA(這兩個都是I型DNA硫化修飾系統(tǒng)的)的活性位點半胱氨酸雖然處在不同的相對位置和不同的二級結(jié)構(gòu)上,但都有著向各自的底物半胱氨酸的運動。
本研究進(jìn)一步通過在上海光源BL19U2生物小角X射線散射(簡稱SAXS)線站收集的數(shù)據(jù),從頭搭建了SspA在溶液中結(jié)構(gòu)的分子模型。發(fā)現(xiàn)SspA在溶液中的結(jié)構(gòu)與分子動力學(xué)模擬后SspA的結(jié)構(gòu)更為接近,它們之間的SAXS數(shù)據(jù)的χ2偏差只有1.04埃,遠(yuǎn)低于從SspA的晶體結(jié)構(gòu)推算出的SAXS數(shù)據(jù)之間的χ2偏差3.70埃。這從實驗上證實了前述的計算機分子動力學(xué)模擬和簡正模式分析的結(jié)果。
弧菌SspA的活性位點半胱氨酸在催化過程中,活性位點半胱氨酸朝向底物半胱氨酸移動了5.5埃的距離
(A)分子動力學(xué)模擬 (B)簡正模式分析
(C)小角X射線散射實驗數(shù)據(jù)與晶體結(jié)構(gòu)經(jīng)過分子動力學(xué)模擬后的結(jié)果和晶體結(jié)構(gòu)的比較
本研究通過X射線晶體結(jié)構(gòu)解析、分子動力學(xué)模擬、小角X射線散射等多種研究手段的結(jié)合,揭示了細(xì)菌DNA硫化修飾這一神奇現(xiàn)象中催化關(guān)鍵的第一步半胱氨酸底物脫硫反應(yīng)的酶的催化機理,解答了半胱氨酸脫硫酶家族是如何克服活性位點半胱氨酸與底物半胱氨酸之間很長的距離這一長期懸而未決的問題,使人們對于細(xì)菌DNA硫化修飾的認(rèn)識和理解又前進(jìn)了一步。該研究獲國家自然科學(xué)基金(31872627、31670106)的支持。????

掃碼關(guān)注,查看更多科技成果