全球每年因創(chuàng)傷、燒傷及外科手術(shù)引發(fā)的嚴(yán)重軟組織損傷病例超千萬例,涉及皮膚、肌肉、神經(jīng)等多種組織。當(dāng)前臨床治療軟組織缺損仍面臨組織再生難題——現(xiàn)有療法多誘導(dǎo)纖維化瘢痕修復(fù),導(dǎo)致功能喪失與外觀受損雙重困境。在再生醫(yī)學(xué)領(lǐng)域,以水凝膠為代表的生物材料雖展現(xiàn)出促進(jìn)創(chuàng)面愈合的潛力,卻難以突破無瘢痕修復(fù)的瓶頸;傳統(tǒng)材料在修復(fù)過程動態(tài)組織適配、免疫響應(yīng)誘導(dǎo)等關(guān)鍵再生環(huán)節(jié)仍存在顯著局限。
北京航空航天大學(xué)生物與醫(yī)學(xué)工程學(xué)院、生物力學(xué)與力學(xué)生物學(xué)教育部重點實驗室、北京生物醫(yī)學(xué)工程高精尖創(chuàng)新中心樊瑜波教授/侯森助理教授團(tuán)隊創(chuàng)新性地通過液-液相分離精準(zhǔn)調(diào)控技術(shù),開發(fā)出具有連續(xù)微孔網(wǎng)絡(luò)的可注射水凝膠顆粒和基于顆粒的水凝膠支架(PPG),通過微孔結(jié)構(gòu)精準(zhǔn)調(diào)控實現(xiàn)了傷口無瘢痕愈合,為組織再生提供了全新解決方案(圖1)。研究團(tuán)隊通過精密調(diào)控膠凝相與成孔相的分離動力學(xué),構(gòu)建了具有分級微孔結(jié)構(gòu)的可注射水凝膠。這種設(shè)計不僅保留了水凝膠的可注射特性,更形成了有利于細(xì)胞遷移和血管化的微孔網(wǎng)絡(luò)。動物實驗顯示,PPG支架展現(xiàn)出卓越的再生能力,在小鼠模型中通過促進(jìn)成熟血管網(wǎng)絡(luò)形成,誘導(dǎo)巨噬細(xì)胞向促修復(fù)型M2表型極化(M2/M1比值顯著升高),激活CD4+Foxp3+調(diào)節(jié)性T細(xì)胞,最終實現(xiàn)含毛囊結(jié)構(gòu)的無瘢痕皮膚再生;在大動物實驗中(豬全層皮膚缺損模型),凝膠的細(xì)胞浸潤效率顯著高于臨床金標(biāo)準(zhǔn)(膠原/蛋白多糖支架)材料,提高了表皮-真皮整合度和真皮再生質(zhì)量。相較于傳統(tǒng)方法依賴生物活性因子的添加,該技術(shù)通過物理拓?fù)浣Y(jié)構(gòu)調(diào)控即可實現(xiàn)組織微環(huán)境重塑,避免生物活性組分帶來的免疫排斥風(fēng)險,顯著降低治療成本,適用于臨床和戰(zhàn)創(chuàng)傷等緊急醫(yī)療場景。相關(guān)工作以“Micropore structure engineering of injectable granular hydrogels via controlled liquid-liquid phase separation facilitates regenerative wound healing in mice and pigs”為題發(fā)表在《Biomaterials》。

圖1.微孔結(jié)構(gòu)工程水凝膠的制備及其促進(jìn)無疤痕傷口愈合的效果示意
研究團(tuán)隊開發(fā)了一種獨特的W/W/O雙乳化方法,采用可控的液-液相分離技術(shù)制備初級水乳液(W/W),然后將這種初級乳液加入到油中(W/W/O),形成具有相分離結(jié)構(gòu)的微滴,然后使用紫外光照射交聯(lián)形成水凝膠微球。根據(jù)Stokes定律(V∝1/η)的預(yù)測,增加外部GelMA相的粘度會降低PEO相的遷移率和聚結(jié)率,并穩(wěn)定其形貌。在中等PEO體積比(1/3)和高HA濃度(0.5%,w/v)下,可獲得期望的連續(xù)微孔結(jié)構(gòu)(圖2C,2D)。微球內(nèi)孔隙大小為5——40μm(圖2E,2F),適宜細(xì)胞浸潤。Comsol軟件仿真的結(jié)果進(jìn)一步證明了外部水相粘度對內(nèi)水相融合的重要影響(圖2G,2H)。

圖2.通過控制相分離實現(xiàn)微孔結(jié)構(gòu)精準(zhǔn)調(diào)控
為了制造基于顆粒的水凝膠支架,研究團(tuán)隊首先將疊氮基團(tuán)化學(xué)偶聯(lián)到微凝膠表面,然后與多臂聚乙二醇(PEG-DBCO)通過點擊化學(xué)反應(yīng),在5分鐘內(nèi)可以注射并成形(圖3A)。共聚焦顯微鏡顯示了PPG支架的內(nèi)部結(jié)構(gòu),顯示了相互連通的顆粒內(nèi)和顆粒間的孔隙,而NPG凝膠僅具有顆粒間孔隙(圖3B);掃描電鏡進(jìn)一步證實了這一點(圖3C)。3D共聚焦圖像分析表明,與NPG凝膠(25.5%)相比,PPG凝膠的孔隙度(50.6%)增加了近兩倍(圖3D)。支架交聯(lián)前的流變學(xué)測試表明,開孔和無孔微凝膠的剪切稀化行為相似(圖3E);凝膠化后,PPG凝膠表現(xiàn)出彈性固體行為,儲存模量為——170 Pa,略低于化學(xué)成分相同的NPG凝膠(圖3F)。

圖3. PPG水凝膠支架的制備與表征
研究團(tuán)隊采用夾板固定C57/BL6小鼠創(chuàng)面模型(圖4A),通過殘余創(chuàng)面面積動態(tài)監(jiān)測評估愈合進(jìn)程(圖4B)。實驗數(shù)據(jù)顯示,PPG凝膠組在術(shù)后第5天和第10天創(chuàng)面閉合率顯著優(yōu)于無孔凝膠組(p<0.05)(圖4C)。角蛋白14免疫熒光染色揭示,PPG組第10天已形成完整表皮結(jié)構(gòu),基底層細(xì)胞排列緊密有序(圖4D,4E),而對照組僅見不連續(xù)薄層表皮。關(guān)鍵組織再生指標(biāo)顯示,PPG支架在D5時間點的細(xì)胞密度較NPG及無孔凝膠分別提高2.1倍和3.1倍(p<0.001)(圖4F-H)。共聚焦三維重構(gòu)證實,PPG組細(xì)胞可穿透單個微球形成深度浸潤網(wǎng)絡(luò),而NPG組細(xì)胞僅分布于顆粒間隙(圖4G插圖)。值得注意的是,PPG組第10天支架體積顯著減小(圖4H),其加速降解特性為新生組織騰出重構(gòu)空間。CD31/α-SMA雙標(biāo)染色顯示(圖4I-K),PPG組功能性血管密度達(dá)NPG組的4倍(p<0.01),且血管網(wǎng)絡(luò)均勻分布于整個支架區(qū)域。相反,NPG組血管密度從邊緣到中心顯著下降,中心區(qū)域幾乎沒有新生血管。這種差異印證了多級孔隙結(jié)構(gòu)通過以下機制促進(jìn)血管化:互連孔道引導(dǎo)內(nèi)皮細(xì)胞定向遷移,加速降解提供空間允許平滑肌細(xì)胞包裹塑形,形成成熟血管。

圖4.PPG水凝膠在小鼠模型中促進(jìn)傷口愈合和快速血管化
生物材料支架引發(fā)的免疫應(yīng)答是決定組織再生效果的關(guān)鍵因素。實驗數(shù)據(jù)顯示,術(shù)后第10天PPG凝膠治療組的促炎性M1型巨噬細(xì)胞(CD68+CCR7+)密度僅為NPG對照組的1/10(圖5A-B)。與之形成鮮明對比的是,PPG組中抗炎型M2巨噬細(xì)胞(CD68+Arg-1+)與M1亞群的比例顯著提升(P<0.01)。更值得注意的是,PPG組創(chuàng)面微環(huán)境內(nèi)調(diào)節(jié)性T細(xì)胞(Treg,CD4+Foxp3+)的浸潤濃度達(dá)到對照組的4.8倍(圖5C-D)。組織學(xué)分析顯示,Treg細(xì)胞在傷口邊緣成熟愈合區(qū)的密度顯著高于核心新生組織區(qū)域,印證了其在促進(jìn)組織穩(wěn)態(tài)重建中的空間特異性調(diào)控作用。這些證據(jù)鏈提示,PPG凝膠的三維多孔結(jié)構(gòu)可能通過調(diào)控巨噬細(xì)胞表型極化,協(xié)同增強Treg細(xì)胞的募集,從而構(gòu)建出利于組織功能性再生的免疫微環(huán)境。

圖5.PPG水凝膠在小鼠模型中調(diào)節(jié)免疫反應(yīng)
為評估PPG凝膠對毛囊再生的調(diào)控作用,研究團(tuán)隊對術(shù)后第21天的創(chuàng)面組織切片進(jìn)行系統(tǒng)分析。組織學(xué)結(jié)果顯示:空白對照組僅形成纖維化瘢痕組織,NPG組呈現(xiàn)局限性毛囊發(fā)育伴隨半纖維化基質(zhì)沉積,而PPG治療組則成功再生出與健康皮膚組織相當(dāng)?shù)拿医Y(jié)構(gòu)(圖6A-B)。通過SOX9(毛囊干細(xì)胞標(biāo)記物)與Keratin14(毛囊外根鞘標(biāo)記物)雙重免疫熒光染色,進(jìn)一步驗證新生毛囊的完整形態(tài)學(xué)特征(圖6C)。結(jié)合術(shù)后第10天轉(zhuǎn)錄組測序數(shù)據(jù)顯示,PPG組中炎性反應(yīng)相關(guān)通路被顯著抑制(圖7),從分子機制層面揭示了材料促進(jìn)皮膚再生的生物學(xué)基礎(chǔ)。

圖6.PPG水凝膠在小鼠模型中促進(jìn)毛囊再生

圖7.手術(shù)后第10天小鼠皮膚傷口RNA測序
為驗證PPG凝膠的臨床轉(zhuǎn)化潛力,研究團(tuán)隊在豬全層皮膚缺損模型中將其與市售人工真皮再生基質(zhì)(ADRM)進(jìn)行系統(tǒng)性對比(圖8A)。實驗數(shù)據(jù)顯示,PPG組與ADRM組在第10天具有相當(dāng)?shù)膭?chuàng)面收縮率(圖8B),但組織學(xué)分析揭示PPG組呈現(xiàn)顯著增強的表皮再上皮化進(jìn)程(圖8C)。值得注意的是,PPG的連通微孔結(jié)構(gòu)結(jié)構(gòu)展現(xiàn)出優(yōu)異的細(xì)胞浸潤能力,其組內(nèi)浸潤細(xì)胞數(shù)量較ADRM組顯著提升(P<0.001),且細(xì)胞在支架內(nèi)呈均勻空間分布(圖8D)。至術(shù)后24天,兩組均完成表皮覆蓋(圖8E),但PPG組實現(xiàn)表皮-真皮連接部結(jié)構(gòu)的生理性重建,其表皮厚度更為均勻(圖8F)。同時,PPG組材料完全降解,再生真皮具有類似于健康組織的膠原結(jié)構(gòu)。這些證據(jù)表明,PPG凝膠通過精準(zhǔn)調(diào)控的降解動力學(xué)與細(xì)胞外基質(zhì)仿生拓?fù)浣Y(jié)構(gòu),建立了利于細(xì)胞遷移/分化的動態(tài)微環(huán)境,從而在保證表皮快速修復(fù)的同時促進(jìn)真皮組織的功能性再生。

圖8.PPG在豬模型中促進(jìn)傷口愈合
本研究創(chuàng)新性地開發(fā)了一種基于微孔結(jié)構(gòu)精準(zhǔn)調(diào)控的水凝膠制備策略,成功實現(xiàn)了皮膚創(chuàng)面的無瘢痕再生修復(fù)。實驗結(jié)果表明,通過拓?fù)浣Y(jié)構(gòu)優(yōu)化設(shè)計的水凝膠支架具有以下多重生物功能:(1)建立三維仿生微環(huán)境,促進(jìn)宿主細(xì)胞的主動遷移與浸潤;(2)顯著抑制創(chuàng)面過度炎癥反應(yīng);(3)誘導(dǎo)形成高密度的成熟血管網(wǎng)絡(luò)。值得關(guān)注的是,該技術(shù)體系完全摒棄外源性細(xì)胞、生長因子或生物活性分子的添加,通過物理-化學(xué)協(xié)同作用機制實現(xiàn)功能性皮膚組織的原位再生,極大降低了臨床轉(zhuǎn)化難度。該突破性技術(shù)不僅為皮膚再生醫(yī)學(xué)提供了全新解決方案,其仿生設(shè)計理念還可延伸應(yīng)用于外周神經(jīng)損傷、肌肉缺損及內(nèi)臟軟組織創(chuàng)面等復(fù)雜組織修復(fù)領(lǐng)域,具有重要的臨床轉(zhuǎn)化價值和廣闊的產(chǎn)業(yè)化前景。
北京航空航天大學(xué)樊瑜波教授和侯森助理教授為該論文的共同通訊作者,博士研究生關(guān)淇峰為論文的第一作者。本研究受到國家自然科學(xué)基金(32071339,T2288101,12332019,U20A20390)和中央基本科研業(yè)務(wù)費等項目經(jīng)費資助。





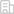

.jpg)