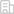2025年1月30日,復旦大學上海醫學院陸路研究員、孫蕾研究員、姜世勃教授團隊合作在《細胞》(Cell)雜志以Research Article的形式,在線發表了題為“Early fusion intermediate of ACE2-using coronavirus spike acting as antiviral target”的研究論文。該研究發現了ACE2受體誘導的冠狀病毒刺突蛋白早期融合中間態構象(E-FIC),并針對該中間態構象設計了高效、廣譜、兼具失活病毒和抑制病毒感染的雙功能抗冠狀病毒候選藥物。

解密ACE2受體誘導的冠狀病毒刺突蛋白早期融合中間態構象
在包膜病毒入侵宿主細胞的過程中,一些病毒能夠借助其表面蛋白介導其包膜與宿主細胞膜融合,進而將遺傳物質注入細胞開啟感染進程。膜融合是病毒建立感染的關鍵環節之一。
在冠狀病毒家族中,這一環節由病毒表面刺突(Spike,S)蛋白介導完成。以新冠病毒為例,S1亞基產生構象變化,進而暴露出其受體結合域(RBD),并通過該結構域結合細胞受體。S1亞基與細胞受體的結合會觸發S1亞基解離,當S2亞基中蛋白酶水解位點(S2’)被宿主蛋白酶切割后,S2亞基中的融膜肽(FP)彈出并插入宿主細胞膜,以此啟動膜融合。最終,HR1形成三螺旋束,HR2則折疊成螺旋狀,并與HR1三螺旋緊密結合,形成穩定的六螺旋束,促使病毒包膜與宿主細胞膜完成融合。
近年來,眾多研究團隊成功揭示了SARS-CoV、MERS-CoV、SARS-CoV-2以及其他一些冠狀病毒S蛋白的RBD與受體結合的復合物構象,以及S蛋白三聚體與受體結合的融合前構象。姜世勃、陸路等研究團隊也發現了MERS-CoV(Nature Communications 2014)、SARS-CoV-2(Cell Research 2020)等S蛋白HR1/HR2形成六螺旋的融合后構象。
但目前仍有一個關鍵問題尚未明確——刺突蛋白從融合前狀態轉變為融合后狀態時,究竟經歷了怎樣的構象變化。雖然已有研究者發現新冠病毒S2亞基中間態構象,但是對于早期的融合中間態,特別是介于受體結合和S1亞基脫落之間的S蛋白構象是否存在,及其變構細節等還一直處于認知盲區。
融膜肽如何跨越病毒包膜和細胞膜之間的“長途”距離,有效插入細胞膜?為何S2’位點切割對于新冠病毒誘導的膜融合起著至關重要的作用?短暫暴露的S蛋白融合中間態構象是否存在新的廣譜抗病毒藥物靶點以及能否針對該類靶點設計新型藥物?在膜融合起始階段,出現了一系列亟待解答的重要科學問題,并成為科學家們一直以來重點關注的焦點。
傳統觀點通常認為,冠狀病毒S1亞基在結合受體并脫落后,會觸發S2亞基構象重排,進而暴露HR1結構域。因此,研究團隊對新冠病毒S蛋白是否存在介于ACE2受體結合和S1亞基脫落之間的特殊構象進行了探索。
團隊首先利用利用流式細胞術,發現跨膜表達的S蛋白在受到ACE2蛋白胞外域的刺激后,能夠結合HR1抗體或其配體多肽EK1,而此時S1亞基還沒有脫落,提示可能存在一種不同于傳統觀點的早期融合中間態構象。為了捕獲并直觀地呈現S蛋白的這種中間態構象,研究團隊對S蛋白與ACE2胞外域共孵育產物進行冷凍電鏡顆粒篩選。通過長時間的摸索,研究者成功發現并解析了一種高分辨率(3.45 Å)的早期融合中間態構象(E-FIC)。
在E-FIC中,S2亞基發生了構象轉變,其中HR1三螺旋結構彈出,而S1亞基組成環狀結構結合在S2亞基的底部。通過進一步的結構優化和分析,研究者發現在E-FIC S2亞基的HR1上結合著一段氨基酸序列,將其命名為中間態環——IL770。值得注意的是,S2’位點就位于IL770中,且突出于結合表面形成隆起,這種結構特征有利于蛋白酶的切割。
此外,通過上述構象可以推測蛋白酶對S2’位點的切割可能觸發IL770從HR1表面剝脫,從而釋放空間以利于HR2結合。通過對融合前和E-FIC結構的對比分析,研究者進而發現S蛋白結合ACE2受體后,S1亞基和S2亞基底部均會向細胞膜方向旋轉以實現病毒膜和細胞膜初步拉近,這將有助于縮短融膜肽插入細胞膜所需的距離(圖1)。
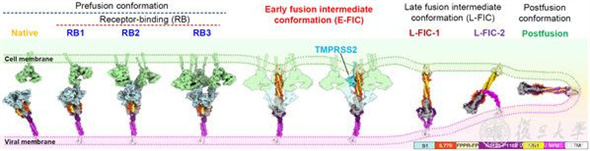
圖1 SARS-CoV-2 S蛋白在誘導膜融合過程中經歷的構象變化
設計高效雙功能抗病毒候選藥物,為開發新型靶向性廣譜藥物或疫苗提供新思路
通過對E-FIC結構的分析,研究者還發現S1亞基中的RBD與S2亞基中的HR1之間的空間距離被拉近,這一發現也為靶向該中間體的藥物設計提供了新思路(圖2)。基于此構象,研究者選用了經臨床試驗證明具有較好活性和安全性的RBD結合藥物候選(ACE2蛋白)和HR1的結合藥物候選(EK1多肽),設計出雙功能域串聯藥物候選。
據介紹,由于E-FIC結構中HR1表面被IL770所結合,研究者通過競爭性結合實驗發現,EK1多肽能夠憑借強大的相互作用從IL770中奪取HR1進行結合。隨后,為了驗證雙功能域之間最佳連接子長度,研究者通過表達含有2、5、6、7組連接子的蛋白進行活性篩選,發現由 5組連接子串聯的蛋白(AL5E)具有最佳靶點結合活性和廣譜性。
后續研究結果表明,上述設計的蛋白類抗病毒活性分子具有失活病毒和抑制病毒雙功能。從失活病毒功能方面看,AL5E蛋白上的ACE2功能域誘導游離病毒表面的S蛋白形成融合中間態,該中間態暴露出靠近ACE2的HR1區,隨后AL5E蛋白中的EK1功能域與HR1三聚體結合,造成病毒S蛋白鎖定在融合中間態,使該病毒粒子喪失感染活性。從抑制病毒功能方面看,AL5E蛋白上的ACE2功能域和EK1功能域也可分別作為抑制劑,抑制病毒對靶細胞的感染。AL5E對新冠病毒及其變異株的抑制活性比ACE2蛋白提高26至623倍,對游離病毒的失活活性提高21至754倍。此外,AL5E對其他使用ACE2受體的冠狀病毒均具有很好的抗病毒效果。
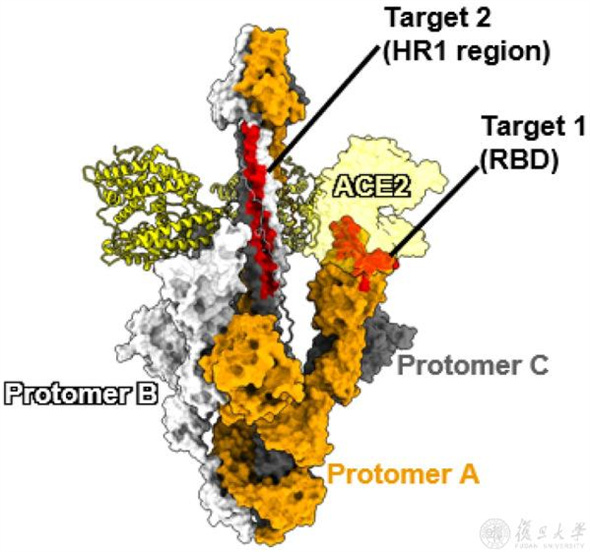
圖2 E-FIC中RBD與HR1之間的空間距離拉近
同時,為了進一步探究所設計的雙功能分子在體內的活性。研究團隊借助新冠病毒變異株BA.5.2和人冠狀病毒NL63感染小鼠的模型,分別對AL5E蛋白在病毒感染治療和病毒失活方面的效果展開了評估。結果顯示,AL5E能夠顯著降低小鼠肺臟中病毒載量。
這些研究不僅揭示了冠狀病毒S蛋白在膜融合早期階段經歷的構象變化細節,還發現了其中的一些潛在藥物靶點,為深入探索冠狀病毒的膜融合機制及開發新型靶向性廣譜藥物或疫苗提供了新的思路。
復旦大學上海醫學院陸路研究員、孫蕾研究員和姜世勃教授為本文的共同通訊作者;邢立曉博士后、劉治民博士、王欣玲青年研究員和劉倩瑩博士為本文共同第一作者。