2025年1月15日,云南大學(xué)生命科學(xué)中心陳慶鋒課題組聯(lián)合復(fù)旦大學(xué)李保賓團隊和法國蒙彼利埃大學(xué) Jean-luc Battini 團隊在 Nature Communications 雜志發(fā)表題為“ Structural basis of phosphate export by human XPR1 ”的研究論文,報道了人源磷酸鹽(Pi)外排蛋白XPR1 兩種構(gòu)象下的高分辨冷凍電鏡結(jié)構(gòu),并結(jié)合體外轉(zhuǎn)運實驗和計算生物學(xué)等手段,揭示了XPR1 向細胞外轉(zhuǎn)運Pi的結(jié)構(gòu)基礎(chǔ),為未來進一步深入的機制研究和靶向該蛋白的藥物開發(fā)奠定了基礎(chǔ)。

磷在各種生物體內(nèi)都是必不可少的,對維持生命活動至關(guān)重要。在細胞水平上,Pi的攝取與外排是由特定的轉(zhuǎn)運蛋白來介導(dǎo)的,它們協(xié)同作用來維持細胞內(nèi)的Pi平衡;細胞內(nèi)Pi濃度失衡可引起一系列人類疾病,比如佝僂病、心血管疾病、骨軟化癥等。在脊椎動物中,SLC20 和 SLC34 等蛋白家族的成員負責(zé)將Pi攝入細胞內(nèi)。相比之下,參與細胞 Pi 外排的蛋白則知之甚少,XPR1 及其同源蛋白是目前唯一被報道參與 Pi 外排的蛋白。XPR1 功能異常與家族性腦鈣化(PFBC)、血栓等疾病相關(guān),同時 XPR1 還可作為舌鱗狀細胞癌的診斷標(biāo)志物。XPR1由一個具有多個跨膜螺旋的跨膜結(jié)構(gòu)域和一個位于胞質(zhì)內(nèi)的SPX結(jié)構(gòu)域。有研究表明, SPX 結(jié)構(gòu)域能夠感知細胞內(nèi)肌醇焦磷酸(PP-InsP)水平,從而調(diào)節(jié)細胞對Pi的攝取、儲存和利用。除了單獨SPX結(jié)構(gòu)域的晶體結(jié)構(gòu)外,此前關(guān)于XPR1的結(jié)構(gòu)信息仍較少。同時,XPR1 是否為Pi外排蛋白以及其如何外排Pi,仍然懸而未決。
該研究解析了人源XPR1野生型(XPR1WT) 和PP-InsP結(jié)合位點突變體(XPR13mut) 的冷凍電鏡結(jié)構(gòu),揭示了其同源二聚體的整體構(gòu)架。這些結(jié)構(gòu)的跨膜結(jié)構(gòu)域(transmembrane domain,TMD)分辨率較高,而SPX結(jié)構(gòu)域則因其內(nèi)在柔性而幾乎完全不可見。在TMD中,每個單體有10個跨膜螺旋(TMs),其中TM1、TM3-4組成支架結(jié)構(gòu)域(scaffold domain),而(TM2、TM5-10)則組成核心結(jié)構(gòu)域(core domain),后者在結(jié)構(gòu)上與轉(zhuǎn)運離子的視紫紅素蛋白(rhodopsin)有著遠緣同源。
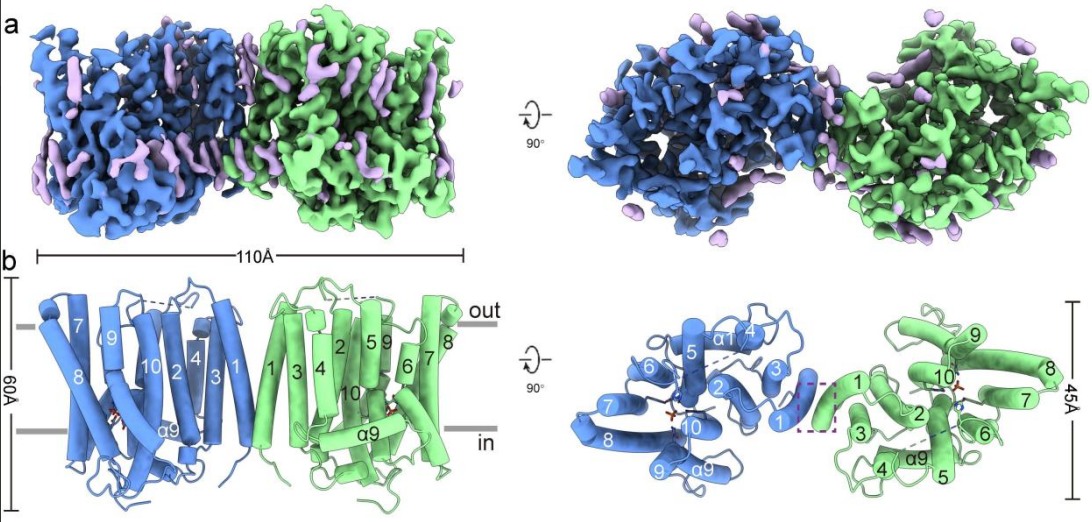
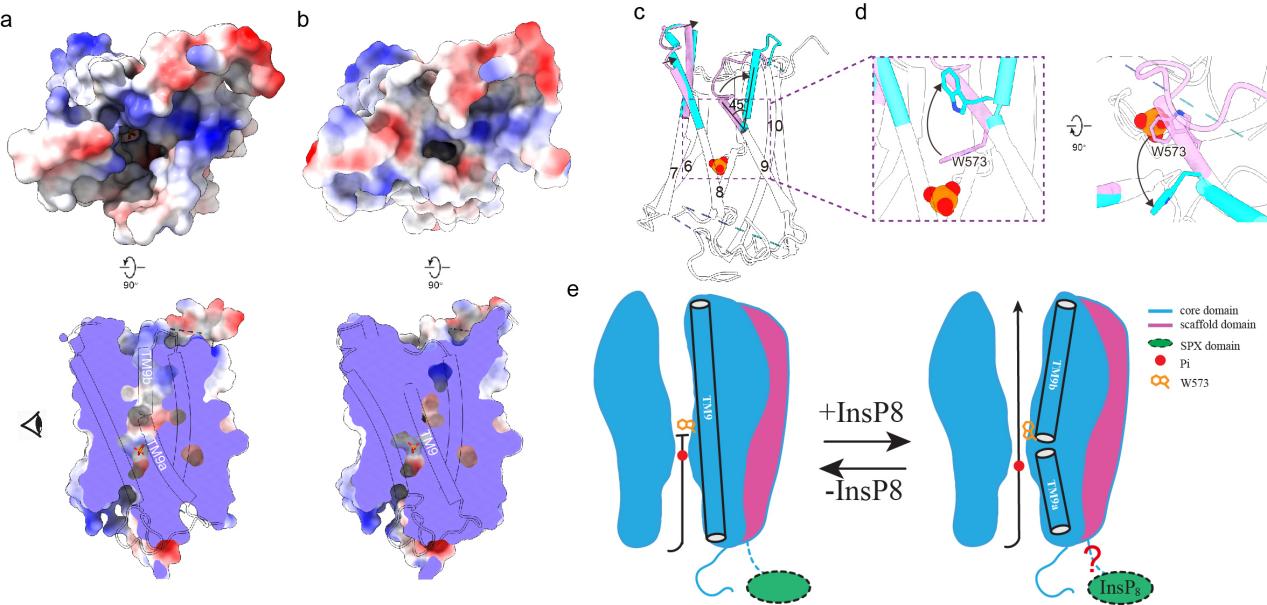
在核心結(jié)構(gòu)域中,各TM圍成一個桶狀結(jié)構(gòu),在其內(nèi)形成一個連續(xù)的離子轉(zhuǎn)運通路。在離子轉(zhuǎn)運通路的最窄處(通路中心靠近細胞內(nèi)側(cè)),形成了Pi的結(jié)合位點,從而將該通路分隔成胞內(nèi)前庭(IV)和胞外前庭(EV)兩部分。有研究表明,在PP-InsPs合成受阻的情況下,動物細胞中的 Pi 外排水平較低,表明 XPR1可能受PP-InsPs激活打開。與之相符的是,PP-InsP結(jié)合位點突變體XPR13mut 的EV處于閉合狀態(tài),而XPR1WT的EV則處于開放狀態(tài),主要是由TM9 和 W573 側(cè)鏈的結(jié)構(gòu)變化來引起的。這些結(jié)構(gòu)研究的結(jié)果表明,XPR1的工作原理更接近于離子通道。
云南大學(xué)生命科學(xué)學(xué)院碩士研究生何其先、復(fù)旦大學(xué)腦科學(xué)轉(zhuǎn)化研究院副研究員張然、蒙彼利埃傳染病研究所Sandrine Tury為該論文的共同第一作者。陳慶鋒教授、李保賓研究員和Jean-luc Battini教授為共同通訊作者。該研究工作得到了中國國家科技創(chuàng)新2030重大項目、國家自然科學(xué)基金、the Fondation pour la Recherche Médicale、天津市杰出青年學(xué)者基金、云南省杰出青年學(xué)者基金、云南省興滇英才計劃、博士生服務(wù)產(chǎn)業(yè)科研創(chuàng)新培育項目、云南大學(xué)研究生創(chuàng)新項目等的資助。
全文鏈接:https://www.nature.com/articles/s41467-025-55995-8






.jpg)