日前,我校化學與材料科學學院陳希教授與華中科技大學吳鈺周、鐘芳銳教授合作,以共同通訊作者在Nature主刊在線發表文章“Enantioselective[2+2]-cycloadditions with triplet photoenzymes”。
酶是生命體重要的組成部分。酶催化具有高效、高度空間立體選擇性和綠色環保特性。近些年來,對酶的改造和定向進化在合成生物學領域有許多突破,但對于酶的高效光催化鮮有報道。
這項工作是酶催化光化學領域的關鍵性突破。研究者將三線態能量轉移這一典型的光催化模式整合到蛋白質中,通過基因重新編程,將功能改性的非天然氨基酸插入蛋白質,創造出含有三線態光敏劑的人工光酶,成功催化吲哚衍生物的分子內[2+2]光激發環加成反應,并且可以實現利用人工光酶與底物分子立體化學的非共價鍵相互作用控制[2+2]光激發環加成反應過程中的對映體選擇性,實現高達99%e.e對映體選擇性。
對該人工酶的進化共經歷了四個階段。到第三個階段(TPe3.0),e.e值達到93%。為了進一步對該酶進行優化,陳希教授團隊解析了該人工光酶與底物的復合體晶體結構,揭示了超分子蛋白質腔中的人工三線態光酶能量轉移反應活性極大提高和催化高度空間立體選擇性的機制:在疏水性蛋白質空腔內,通過π-π堆積作用,光能從非天然氨基酸傳導到底物,激活反應。底物和周邊氨基酸殘基的弱相互作用決定了產物單一手性構象。基于這個機制,該研究團隊設計了TPe4.0_FBP,將11位的丙氨酸突變為天冬酰胺,增加了該氨基酸殘基與底物的氫鍵作用。同時,在非天然氨基酸上添加了一個氟原子,增長了π-π共軛,并增加了一個C-F氫鍵。基于這些改造,e.e值最終達到99%。陳希教授團隊也成功解析了TPe4.0_FBP與底物的復合體晶體結構(后續工作),驗證了這一機制。
這項研究工作將化學光敏劑與蛋白質結構相結合,創造了新型“三重態光酶”,豐富了光驅動生物催化的功能和應用范圍。同時實現高手性控制,為醫藥、農藥、信息和材料領域的發展提供核心技術支持。
陳希,2004年在清華大學取得學士學位。2011年在新加坡國立大學取得博士學位。2012年至2015年底在奧斯陸大學醫院從事博士后工作。2016年在國家分子醫學轉化中心從事科研工作。2017年在美國德克薩斯州立大學艾爾帕索分校做訪問學者。2017年入職西北大學化學與材料科學學院。
主要研究天然產物合成酶和與疾病、藥物相關的蛋白質的結構與功能。文章發表在Nature,The Journal of Biological Chemistry,JCI insight,Nature Structural&Molecular Biology,Journal of the American Chemical Society,Angewandte Chemie International Edition,Chemical Science等期刊上。
“三重態光酶”的藝術示意圖
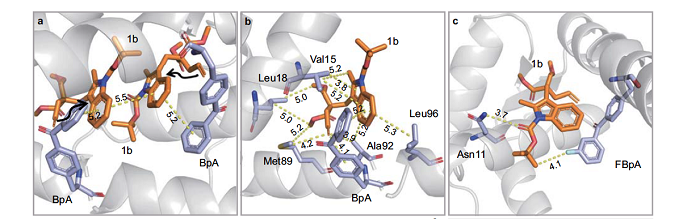
“三重態光酶”的催化機制