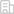2月7日,微生物和化學生物學頂級期刊 Trends in Microbiology在線發表了中國農業大學動物醫學院沈建忠團隊題為“Host acting antibacterial compounds combat cytosolic bacteria”的綜述文章,系統介紹了宿主導向的抗菌化合物在對抗胞質細菌上的最新研究進展和潛在應用價值。
多重耐藥菌引起的感染已經成為全球公共衛生安全最嚴重的威脅之一,然而天然藥物分子庫的枯竭,以及尚未闡明的細菌耐藥機制都極大地阻礙了新型抗菌藥物的研發及應用。沈院士團隊長期致力于耐藥細菌防控,并且已經在新型抗菌藥物研發,細菌耐受性機制以及宿主及共生菌相互作用方面開展了一系列基礎性和應用性研究。近年來,由宿主細胞介導的致病菌耐藥性或耐受性獲得了越來越多的關注。許多致病菌可以適應細胞內環境,以短暫且不生長的生活方式在其中存活,而這些胞內菌也被統稱為胞質細菌(Cytosolic bacteria)。胞質細菌不僅可以利用宿主細胞作為天然屏障來抵御抗菌藥物殺傷,同時它們還會破壞宿主代謝及免疫功能來避免被清除。為了對抗細菌抗菌藥物耐藥性及耐受性,前期研究揭示了低濃度抗菌藥物和細菌毒素可以促進胞質細菌抗菌藥物耐受性的產生(Adv Sci, 2020, 7, 1900840),成功合成了廣譜抗菌增效劑SLAP-S25(Nat Microbiol, 2020, 5, 1040)以提高抗菌藥物在細胞水平及動物體內的療效。同時,鑒于病原微生物與宿主細胞間復雜的相互作用,進一步關注胞質細菌感染下的宿主細胞防御策略,發現植物源黃酮類化合物(Adv Sci, 2021, 8, 2100749)特別是新型聚集誘導發光分子TBPs可以通過調控自噬來加速感染清除(Adv Sci, 2021, 8, 2001750),豐富了近年來提出的宿主導向治療(Host-directed therapies)作為新型替代抗策略。
結合上述研究基礎并為給后續新型藥物研發提供抗菌靶點,本文綜述了近五年內宿主導向抗胞質細菌的化合物(host acting antibacterial compounds, HACs)及其作用機制。不同于傳統抗菌藥物,HACs側重于細菌與細胞互作層面,通過阻斷病原菌對宿主細胞生理活動的脅迫,恢復或增強宿主細胞的代謝及抗菌功能來抑制病原菌感染。新型抗菌藥物研發離不開抗菌新靶點的發現。細菌通常以獨特的時空動態入侵細胞(圖1),HACs潛在的抗菌靶點貫穿了整個感染過程,并可分為阻斷細菌粘附和入侵、抑制胞質細菌的生存和復制、防止病原菌擴散和抑制過度的炎癥。此外,即使作用于同一階段的HACs也可以通過完全不同的信號通路來調節宿主細胞與病原菌的相互作用。作者將HACs以不同功能進行分類,包括重塑宿主細胞質膜、阻斷PAMPs(pathogen-associated molecular patterns)介導的細菌內化、促進細胞內藥物累積、抑制宿主IFN-I信號、抑制胞質細菌耐受性及毒性、提升宿主細胞自噬功能、恢復線粒體功能、抑制糖酵解、加速溶酶體成熟、促進抗菌肽表達和ROS累積、修飾轉錄、抑制細菌誘導宿主細胞肌動蛋白重排和過度炎癥等13種作用方式(圖2A)。
圖1胞質菌入侵宿主細胞的時空規律
全文共收錄了77種HACs(圖2B),其中的50種(64.94%)作用于胞質細菌細胞內生存及復制階段,作者提出后續研究應積極探索可以阻斷細菌粘附和入侵的化合物將感染控制于初始階段。在所有收錄的HACs中,61種(79.22%)為小分子化合物,47種(61.04%)還處于臨床前研究階段 ,提示盡管HACs還處于發展初期,但是可開發資源非常豐富,臨床應用前景良好。
圖2 宿主導向的抗菌化合物(HACs)對抗胞質細菌的作用模式
(A)HACs靶向細菌的不同階段。針對細菌粘附內化,存活/復制,逃逸和炎癥各階段的HACs的作用,將HACs分為13個的類別。
(B)現有HACs(77種)靶向細菌粘附或內化,存活/復制、逃逸和炎癥階段的藥物數量。現有HACs的類別包含抗體,酶,肽,小分子和其他HACs。
最后,作者進一步指出HACs并非直接作用于病原菌,相對較小的選擇壓力使得細菌更不易產生耐藥性,在未來的耐藥菌防控中將扮演重要角色。同時,作者辯證認識到HACs可能存在的一些潛在的劣勢,包括體內活性的不確定性、細胞毒性及脫靶效應等,將在后續的研究中得到重視。
中國農業大學博士畢業生劉曉曄(現為北京農學院專任教師)和吳逸璠(現為深圳大學博士后)為該論文的第一作者,我校引進的杰出人才、沈建忠院士團隊的朱奎教授為通訊作者。本研究受廣東省基礎與應用基礎研究重大專項(2020B0301030007),國家自然科學基金(31922083)和高校科學基金(2021RC005和2021TC058)項目資助。